Microalgas nocivas y salmonicultura: tres protagonistas globales en los fiordos del sur de Chile
Javier Alvarez (Biólogo Marino); Diego Caro (Médico Veterinario). Centro de Investigaciones Biológicas Aplicadas (CIBA).
Las Floraciones Algales son eventos naturales de distribución global, caracterizados por el aumento exponencial de células de determinadas especies de fitoplancton. Cuando estas proliferaciones representan un riesgo para la salud humana o animal, se clasifican como Floraciones Algales Nocivas (FAN) (Hallegraeff, 1993; Anderson et al., 2012). En Chile existe un historial ampliamente documentado de FAN con impactos significativos sobre la acuicultura, especialmente en la salmonicultura.
Si bien distintos grupos taxonómicos pueden estar involucrados, algunas especies adquieren especial relevancia por su capacidad de provocar efectos tóxicos severos y generar mortalidades directas en peces de cultivo. Entre ellas destacan Alexandrium catenella, especies del género Karenia y Pseudochattonella spp., todas reconocidas por su impacto en sistemas de producción intensiva y su recurrencia en fiordos y canales del sur de Chile (Mardones et al., 2021).
La Patagonia chilena ha sido escenario de eventos de alta magnitud asociados a estos agentes, posicionándola como un punto estratégico para el estudio de FAN e ictiotoxicidad. Este fenómeno ocurre en un contexto donde convergen la variabilidad climática, la creciente preocupación por el bienestar animal y la necesidad de avanzar hacia una acuicultura más sustentable.
Especies con efecto Ictiotóxico para la salmonicultura.
Los peces en sistemas de cultivo son particularmente susceptibles frente a eventos de FAN, principalmente porque, a diferencia de los peces silvestres, no pueden evadir las áreas afectadas, quedando expuestos de manera prolongada a altas concentraciones celulares y metabolitos nocivos Diversos estudios han demostrado que, independientemente del tipo de microalga involucrada, la branquia constituye el órgano primariamente afectado, ya sea por daño mecánico, producción de toxinas hemolíticas o hipersecreción de mucus (Hallegraeff, 1993; Brusle, 1995; Mehdizadeh Allaf, 2023).
Entre los efectos más severos esta la acción tóxica directa, ampliamente descritos para microalgas nocivas de importancia acuícola (Landsberg, 2002; Hallegraeff, 2003). Los mecanismos ictiotóxicos más frecuentes incluyen: (i) toxinas como saxitoxinas o hemolisinas producidas por ciertos dinoflagelados, (ii) la producción de ácidos grasos poliinsaturados (PUFAs) bioactivos en raphidofitas como Heterosigma akashiwo, y (iii) la generación de especies reactivas de oxígeno (ROS), capaces de alterar severamente el epitelio branquial (Khan et al., 1996; Iriarte et al., 2023). Dinoflagelados y raphidofitas se encuentran entre los grupos más relevantes, destacando Alexandrium catenella, Karenia spp. y Pseudochattonella spp., todas vinculadas a eventos de mortalidad en peces de cultivo (Smayda, 1997; Dorantes-Aranda et al., 2015).
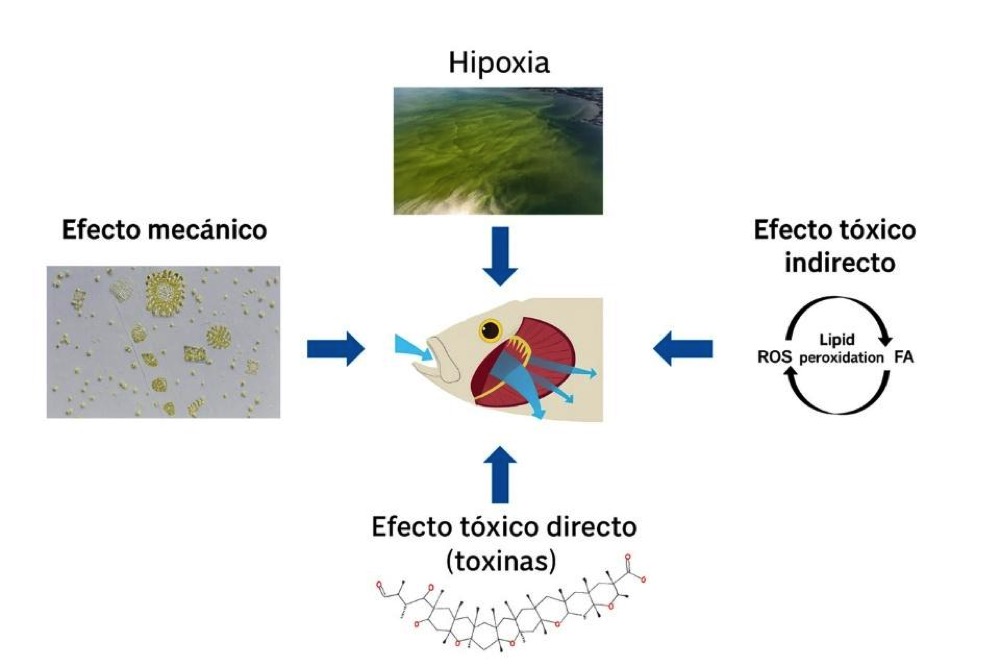
Figura 1. Representación esquemática de los principales mecanismos de daño en salmones durante eventos de Floraciones Algales Nocivas (FAN). Las microalgas pueden generar obstrucción e irritación branquial, inducir hipoxia por altas biomasas y consumo de oxígeno, y provocar efectos tóxicos directos mediante compuestos bioactivos. También pueden causar daño indirecto a través de la generación de especies reactivas de oxígeno (ROS), peroxidación lipídica y ácidos grasos (PUFAs)
Alexandrium catenella
Alexandrium catenella, dinoflagelado marino productor de toxinas asociadas al Veneno Paralizante de los Mariscos (VPM), ampliamente reconocido por su impacto sanitario y económico en pesquerías y sistemas de cultivo. En Chile, constituye una de las microalgas nocivas más estudiadas, cuya expansión territorial desde su primer registro en la región de Magallanes ha sido progresiva, siendo una especie común en la región de Aysén y Los Lagos, representando una amenaza permanente para la salmonicultura (Barría et al., 2022; Paredes-Mella et al., 2020).
Su desarrollo está estrechamente ligado a condiciones ambientales propias de fiordos y mares interiores de latitudes templado-frías, caracterizadas por estratificación, buena disponibilidad de luz y estabilidad en la columna de agua. En el sur de Chile mantiene un patrón marcadamente estacional, con proliferaciones más intensas en primavera y verano, cuando las capas superficiales se estabilizan, las temperaturas se moderan y la mezcla vertical disminuye (Iriarte et al., 2013).
En salmones, los efectos nocivos de A. catenella van más allá de las toxinas reguladas asociadas al VPM. Ensayos experimentales con cepas chilenas han demostrado un modo de acción ictiotóxico basado en la generación de especies reactivas de oxígeno (ROS), la presencia de ácidos grasos poliinsaturados (PUFAs) y la formación de mucus y agregados celulares capaces de dañar el epitelio branquial. Este conjunto de mecanismos puede inducir inflamación, estrés respiratorio e hipoxia, generando mortalidades incluso cuando las concentraciones celulares no alcanzan niveles considerados tradicionalmente peligrosos (Mardones et al., 2015).
De acuerdo a registros obtenidos por el monitoreo realizado por CIBA en centros de cultivo de la X y XI región entre los años 2018 y 2025, esta especie tiene un patrón estacional definido, con presencia marcada de la especie durante el verano y una disminución casi total en invierno y comienzos de la primavera. En el plano espacial, la mayor intensidad se concentra en los fiordos del centro y norte de Aysén, especialmente en sectores de Puerto Aysén, Puerto Cisnes y Melinka, donde la especie tiende a mostrar sus máximos anuales. Más al norte, en Chiloé y la Región de Los Lagos, la señal presencia de esta especie es menor, en línea con los registros históricos descritos para la region (Barría et al., 2022). Esta dinámica queda reflejada también en la gradiente de color del mapa, donde los tonos más intensos resaltan los meses y áreas con mayores concentraciones promedio.
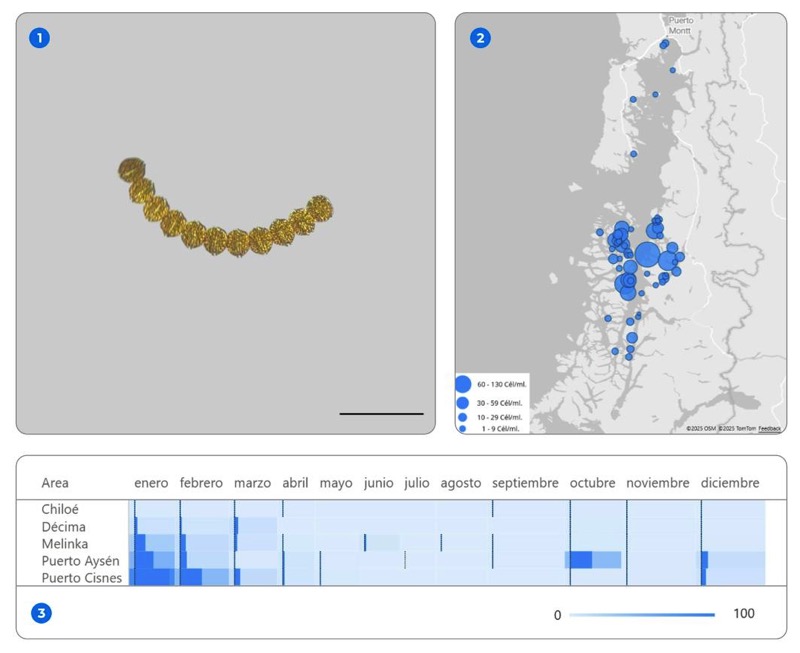
catenella, donde el tamaño de las burbujas representa el promedio acumulado de concentración celular (cél/mL) durante el periodo analizado. (3) Distribución mensual de la especie por área de monitoreo, expresada como promedio de celulas (cél/mL).
A lo largo de las últimas dos décadas, diversos eventos han evidenciado el impacto de A. catenella sobre la salmonicultura chilena. Durante el verano 2001–2002, un extenso bloom entre Aysén y el sur de Chiloé provocó más de 50 intoxicaciones humanas, tres fallecidos y pérdidas superiores a 1.800 toneladas de salmón de cultivo, en un escenario dominado casi por completo por la especie (Fuentes-Grünewald et al., 2008; Yarimizu et al., 2021). En 2005–2006, en los fiordos del norte de Aysén, se registraron abundancias cercanas al umbral de 1.000 cél/mL y un daño branquial severo en peces, lo que derivó en la pérdida de más del 90 % de la biomasa en un centro monitorizado, equivalente a 1.827 toneladas y cerca de USD 9,2 millones (Fuentes-Grünewald et al., 2008). Posteriormente, en 2009, otro bloom de gran escala fue catalogado como uno de los episodios más severos en sistemas de cultivo, con mortalidades distribuidas en un amplio territorio y consecuencias económicas significativas para la industria (Montes et al., 2018; Villanueva et al., 2016). A estos antecedentes se sumó el evento de 2016 en la Región de Los Lagos, donde la presencia simultánea de toxinas paralizantes y condiciones oceanográficas anómalas intensificó el impacto sobre centros de cultivo y pesquerías locales, consolidando a A. catenella como una de las especies más disruptivas para la salmonicultura del país (León-Muñoz et al., 2018; Armijo et al., 2020).
Karenia spp.
El género Karenia, que incluye especies de interés como K. selliformis y K. cf. mikimotoi, corresponde a un grupo de dinoflagelados atecados ampliamente reconocidos por su capacidad de generar mortalidades masivas en peces cuando forman floraciones nocivas en distintas regiones del mundo. En Chile, aislados de Karenia han mostrado efectos tóxicos sobre células branquiales de peces en ensayos de laboratorio, lo que confirma que su presencia en ambientes costeros y fiordos representa un riesgo real para la salmonicultura (Mardones et al., 2020). Los mecanismos de daño incluyen la producción de compuestos lipofílicos y efectos citotóxicos asociados a la ruptura celular, capaces de lesionar el epitelio branquial y comprometer la función respiratoria, incluso sin alcanzar densidades elevadas (Oh et al., 2023; Rolton et al., 2022). Esta combinación (toxicidad relativamente independiente de la densidad y capacidad de generar daño severo) posiciona a Karenia como un género prioritario en los programas de monitoreo fitoplanctónico en la Patagonia y otras zonas de cultivo.
Los registros recopilados por CIBA entre 2018 y 2025 muestran que Karenia mantiene una distribución estival más pareja, con presencia sostenida entre enero y abril en la mayoría de las áreas monitoreadas. Dentro de esta dinámica, destaca el aumento registrado en marzo en el Área Décima, correspondiente a un evento de alta abundancia observado en 2022, donde el promedio multi-anual alcanza cerca de 17 cél/mL. Un comportamiento similar se observa en Melinka, donde ese mismo mes se registra otro de los valores más altos del conjunto, asociado específicamente al año 2018. Todos estos aumentos corresponden a eventos acotados y no se vincularon a episodios de mortalidad significativa en salmones en centros de cultivo.
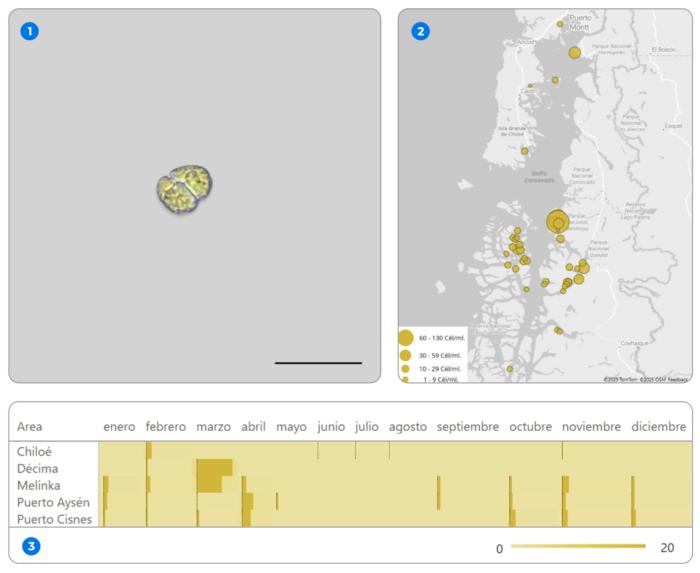
Figura 3. Conjunto de visualizaciones asociadas a la presencia de Karenia spp. en la Región de Los Lagos y la Región de Aysén durante el periodo 2018–2025. (1) Imagen microscópica de Karenia spp. (2) Distribución espacial de Karenia sp., donde el tamaño de las burbujas representa el promedio acumulado de concentración celular (cél/mL) durante el periodo analizado. (3) Distribución mensual de la especie por área de monitoreo, expresada como promedio celular (cél/mL), lo que permite identificar patrones estacionales y la intermitencia de los registros, con mayor presencia relativa en los primeros meses del año.
Entre los eventos más relevantes registrados en Chile se encuentran las floraciones de 1999–2001 en fiordos australes, atribuidas a K. selliformis, las cuales generaron mortalidades localizadas en centros de cultivo y afectaron comunidades bentónicas asociadas (Uribe y Ruiz, 2001; Clement et al., 2001). Asimismo, la especie tuvo un rol documentado durante el evento FAN de 2016, donde se reportaron episodios de irritación branquial en centros del mar interior expuestos a un bloom multiespecífico de alta intensidad (Díaz et al., 2019; Trainer et al., 2020). A ello se suma el evento de 2017 en el Golfo de Penas, cuando K. cf. mikimotoi provocó mortalidad de salmones transportados en wellboats tras la captación de agua cargada de células, generando pérdidas económicas significativas y constituyendo el caso mejor documentado para este género en Chile (Villanueva et al., 2017; IFOP, 2017).
Pseudochattonella spp.
Pseudochattonella spp., incluyendo P. verruculosa, corresponde a una dictyochofícea responsable del mayor evento de mortalidad de peces documentados en el mundo, ocurrido en la X región (Chile) durante la verano del año 2016 (Mardones et al., 2021). Aunque no es un productor directo de toxinas, su impacto se debe a la generación de superóxido, la formación de agregados celulares, la producción de mucus y el deterioro del epitelio branquial, mecanismos que pueden desencadenar mortalidades de peces en corto periodo de tiempo (Mardones et al., 2015; Mardones et al., 2020).
Su presencia suele asociarse a columnas de agua fuertemente estratificadas, periodos prolongados de estabilidad y a la interacción entre capas superficiales cálidas y aguas subsuperficiales más salinas; justamente las condiciones que predominaron durante el verano cálido que antecedió al evento de 2016 (León-Muñoz et al., 2018).
Los registros recopilados por CIBA desde 2018 muestran que Pseudochattonella spp. se presenta principalmente durante la temporada estival, con una recurrencia marcada en la XI región (Melinka, Puerto Aysén y Puerto Cisnes), áreas donde históricamente se han concentrado los episodios más relevantes para la salmonicultura. En estos sectores, especialmente entre enero y marzo, se observan los valores promedio multianuales más altos del conjunto, como los 11 cel/mL registrados en enero en Puerto Cisnes y los 10 cel/mL de marzo en Melinka. A nivel temporal, la especie muestra una mayor presencia entre 2020 y 2022, con Puerto Aysén destacando de manera sostenida durante esos años, lo que confirma su rol como uno de los focos persistentes dentro de la región. Más al norte, en Chiloé y parte de la Región de Los Lagos, su presencia es más esporádica y no conforma un patrón estacional definido. Aunque las abundancias promedio recientes son bajas en comparación con los eventos históricos descritos en la literatura, la especie mantiene un rol activo en la zona y conserva la capacidad de incrementarse rápidamente bajo condiciones favorables.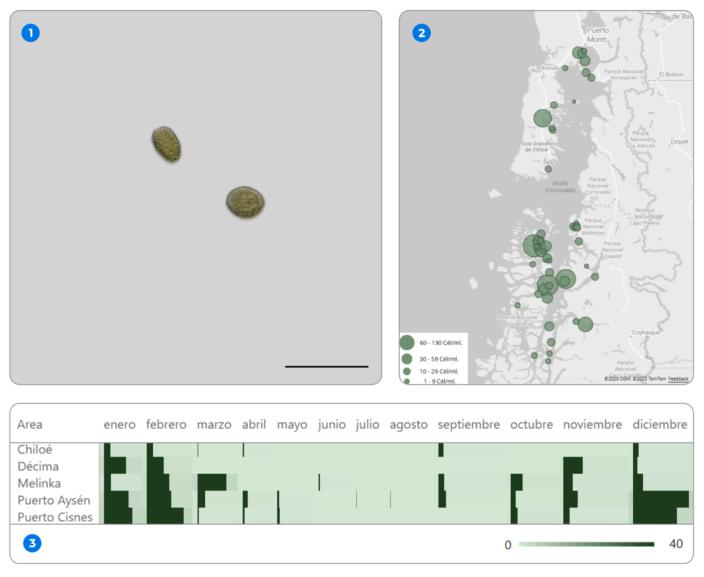
Figura 4. Conjunto de visualizaciones asociadas a la presencia de Pseudochattonella spp. en centros de cultivo de la Región de Los Lagos y la Región de Aysén durante el periodo 2018–2025. (1) Imagen microscópica de Pseudochattonella spp. (2) Distribución espacial de las estaciones de monitoreo, donde el tamaño de las burbujas representa el promedio acumulado de concentración celular (cél/mL) por estación durante el periodo analizado. (3) Distribución mensual de la especie por área de monitoreo, expresada como promedio celular (cél/mL), lo que permite identificar patrones estacionales y la intermitencia de los registros, con mayor presencia relativa durante los primeros meses del año.
En cuanto a los impactos registrados, el evento más emblemático sigue siendo el de 2016, cuando un bloom de Pseudochattonella verruculosa en el seno de Reloncaví y el mar interior de Chiloé provocó la muerte de cerca de 39.942 toneladas de salmones. Las pérdidas totales para la industria se estimaron en torno a 100 mil toneladas a peso cosecha y más de USD 800 millones, lo que posicionó este episodio como uno de los desastres acuícolas más relevantes documentados a nivel global (Comisión Marea Roja, 2016; León-Muñoz et al., 2018; Quiñones et al., 2019).A este antecedente se suman los blooms registrados en 2022 en la región de Aysén, nuevamente asociados a Pseudochattonella spp., que afectaron a distintas empresas con una mortalidad total cercana a 3.550 toneladas y un impacto directo sobre la producción regional (Sernapesca, 2022a; Salmonexpert, 2022; Blumar, 2023).
Más recientemente, a comienzos de 2024, una nueva contingencia asociada a Pseudochattonella spp. en las agrupaciones ACS 22B–22C de Aysén provocó la muerte de aproximadamente 4.994 toneladas de salmones, confirmando que este género sigue siendo una amenaza persistente para la salmonicultura del sur de Chile (Sernapesca, 2024; Terram, 2024; Blumar, 2024).
Los fiordos y canales del sur de Chile reúnen condiciones físicas y biogeoquímicas que los vuelven especialmente sensibles a las FAN ictiotóxicas. La fuerte estratificación producida por el aporte de ríos y deshielo, la estabilidad de la columna de agua, los largos tiempos de residencia y la escasa ventilación en sectores interiores generan un ambiente donde estas microalgas pueden mantenerse y desarrollarse con facilidad. En este escenario, Alexandrium catenella, Karenia spp. y Pseudochattonella spp. han encontrado un territorio fértil para su proliferación, transformándose en protagonistas frecuentes de eventos que afectan de forma directa a la salmonicultura de la Patagonia.
La experiencia acumulada en los últimos años muestra que los programas de monitoreo sistemáticos, estandarizados y con metodologías validadas son fundamentales para entender cómo se comportan estas especies, anticipar escenarios de riesgo y respaldar decisiones operativas, desde la relocalización temporal de centros hasta ajustes de biomasa o cambios en el manejo. En un contexto de cambio climático, desarrollo de bienestar animal y la proyección de sustentabilidad de esta actividad económica, reforzar estos sistemas de monitoreo y conectarlos con herramientas de predicción oceanográfica y planes de contingencia será fundamental para disminuir la vulnerabilidad de la industria frente a las FAN y avanzar hacia un modelo de cultivo más resistente y preparado.
Referencias
● Armijo, J., Alarcón, C., Lagos, N., & Manríquez, P. (2020). The 2016 red tide crisis in southern Chile: Possible influence of the mass oceanic dumping of dead salmons. Marine Pollution Bulletin, 150, 110603.
● Anderson, D. M., Cembella, A. D., & Hallegraeff, G. M. (2012). Progress in understanding harmful algal blooms: Paradigm shifts and new technologies for research, monitoring, and management. Annual Review of Marine Science, 4, 143–176. https://doi.org/10.1146/annurev-marine-120308-081121
● Barría, C., Muñoz, F., & Iriarte, J. L. (2022). Dinámica espacial y temporal de Alexandrium catenella en el sur de Chile. Harmful Algae, 117, 102266.
● Blumar. (2023). Reporte de contingencia FAN 2022. Departamento de Medio Ambiente, Blumar S.A.
● Blumar. (2024). Informe de contingencia por mortalidad asociada a FAN 2024. Departamento de Medio Ambiente, Blumar S.A.
● Bruslé, J. (1995). The impact of harmful algal blooms on finfish: Mortality, pathology and toxicology. In P. Lassus, G. Arzul, E. Erard, P. Gentien, & C. Marcaillou-Le Baut (Eds.), Harmful Marine Algal Blooms (pp. 851–853). Lavoisier.
● Clement, A., Seguel, M., & Guzmán, L. (2001). Floración de Karenia selliformis y su impacto en fiordos australes de Chile. Revista de Biología Marina y Oceanografía, 36(2), 43–57.
● Comisión Marea Roja. (2016). Informe final del Comité Científico: Evento de Floración Algales Nocivas 2016 en el sur de Chile. Ministerio de Economía.
● Díaz, P. A., et al. (2019). Massive harmful algal bloom in southern Chile caused by a multi-species assemblage. Harmful Algae, 82, 1–12.
● Díaz, P. A., et al. (2023). Harmful algal blooms and environmental variability in Patagonian fjords. Marine Environmental Research, 186, 105989.
● Dorantes-Aranda, J. J., et al. (2015). Fish gill damage by harmful algae. Reviews in Fisheries Science & Aquaculture, 23(2), 113–135.
● Fuentes-Grünewald, C., et al. (2008). Recurrent Alexandrium catenella blooms in southern Chile: Impacts and dynamics. Harmful Algae, 7(3), 307–318.
● Hallegraeff, G. M. (1993). A review of harmful algal blooms and their apparent global increase. Phycologia, 32(2), 79–99*.
● Hallegraeff, G. M. (2003). Harmful algal blooms: A global overview. En G. M. Hallegraeff et al. (Eds.), Manual on Harmful Marine Microalgae (pp. 25–49). UNESCO.
● IFOP. (2017). Informe técnico: Mortalidad de salmones asociada a Karenia cf. mikimotoi en Golfo de Penas. Instituto de Fomento Pesquero.
● Iriarte, J. L., et al. (2013). Phytoplankton dynamics in the Patagonian fjords. Progress in Oceanography, 119, 1–32.
● Iriarte, J. L., et al. (2023). Gill physiological responses of salmonids to harmful algae. Aquaculture Environment Interactions, 15, 33–49.
● Khan, S., et al. (1996). Reactive oxygen species production by harmful algae. Marine Biology, 126, 459–467.
● Landsberg, J. (2002). The effects of harmful algal blooms on aquatic organisms. Reviews in Fisheries Science, 10(2), 113–390.
● León-Muñoz, J., et al. (2018). Hydrological anomalies and harmful algal blooms in southern Chile during the 2016 event. Harmful Algae, 80, 44–56.
● Mehdizadeh Allaf, M. (2023). Heterosigma akashiwo, a fish-killing flagellate. Microbiological Research, 14, 132–147. https://doi.org/10.3390/microbiolres14010012
● Mardones, J. I., Dorantes-Aranda, J. J., Nichols, P. D., & Hallegraeff, G. M. (2015). Fish gill damage by the dinoflagellate Alexandrium catenella from Chilean fjords: Synergistic action of ROS and PUFA. Harmful Algae, 49, 40–49Mardones, J. I., et al. (2020). Toxic and harmful characteristics of Chilean Karenia isolates. Harmful Algae, 97, 101853.
● Mardones, J. I., et al. (2021). Pseudochattonella blooms in Chile: Ecology and impacts. Harmful Algae, 102, 101933.
● Mardones, J. I., et al. (2021). Microalgal harmful events affecting salmon farming in Chile. Frontiers in Marine Science, 8, 671821.
● Montes, M., et al. (2018). Severe Alexandrium catenella bloom in southern Chile in 2009. Harmful Algae, 80, 72–85.
● Oh, S. J., et al. (2023). Gill cytotoxicity of Karenia spp. Aquatic Toxicology, 258, 106536.
● Paredes-Mella, C., et al. (2020). Expansion and bloom dynamics of Alexandrium catenella in southern Chile. Harmful Algae, 92, 101728.
● Quiñones, R., et al. (2019). Oceanographic drivers of the 2016 harmful algal bloom in southern Chile. Progress in Oceanography, 175, 175–189.● Rolton, A., et al. (2022). Toxic effects of Karenia blooms on fish. Marine Environmental Research, 181, 105759.
● Salmonexpert. (2022). Pseudochattonella genera nuevas mortalidades en Aysén durante 2022. Salmonexpert.cl.
● Sernapesca. (2022a). Contingencia FAN 2022: Informe de mortalidades por Pseudochattonella spp. Servicio Nacional de Pesca y Acuicultura.
● Sernapesca. (2024). Reporte oficial de contingencia: Evento FAN 2024 en ACS 22B–22C. Servicio Nacional de Pesca y Acuicultura.
● Smayda, T. J. (1997). Harmful algal blooms: Their ecophysiology and general relevance to phytoplankton blooms. Limnology and Oceanography, 42(5), 1137–1153.
● Terram. (2024). Reporte sobre contingencias ambientales en la salmonicultura 2024. Fundación Terram.
● Trainer, V. L., et al. (2020). The 2016 Chilean harmful algal bloom: Global lessons. Harmful Algae, 96, 101799.
● Uribe, J., & Ruiz, M. (2001). Floraciones de dinoflagelados nocivos en los fiordos del sur de Chile. Revista de Biología Marina y Oceanografía, 36(2), 123–137.
● Villanueva, P., et al. (2016). Distribution and impacts of Alexandrium catenella blooms in Chile. Harmful Algae, 55, 1–10.
● Villanueva, P., et al. (2017). Mortalidad de salmones en Golfo de Penas asociada a Karenia cf. mikimotoi. Informe Técnico IFOP 2017.
● Yarimizu, K., et al. (2021). Bloom dynamics of Alexandrium catenella in southern Chile. Harmful Algae, 108, 102102.